高压锂金属电池(LMB)被认为是最有前途的下一代锂电池之一,但锂金属与电解液界面的不稳定性仍然阻碍了锂金属电池的实际应用。要形成稳定锂金属阳极的功能性电解质体系,必须了解溶剂分子的溶剂化行为,因为溶剂化状态会严重影响溶剂的电化学性质。美国阿贡实验室Khalil Amine教授在期刊“Angew. Chem. Int. Edit.”上发表题为“Solvation Rule for Solid-Electrolyte Interphase Enabler in Lithium Metal Batteries”的论文,明确地证明了电解质体系中固体电解质界面(SEI)成膜剂碳酸氟乙烯酯(FEC)的溶剂化规律,结果表明,FEC的溶剂化数(与阳离子配位的SEI成膜剂分子的平均数)必须≥1,以确保形成稳定的SEI。在这种情况下,锂离子平均被至少一个FEC分子溶剂化,不仅在分离的离子中,而且在锂盐未完全解离的情况下,还会被接触离子对或锂聚集体溶剂化。如果FEC的溶剂化数小于1,则电解质中可以存在单独由EMC分子溶剂化的Li+的锂配合物。这些纯EMC溶剂化的Li+配合物的分解对锂负极是有害的,会导致SEI的减弱和循环寿命的缩短。因此,保持FEC溶剂化数≥1是LMBs稳定循环的关键。
【文章详情】
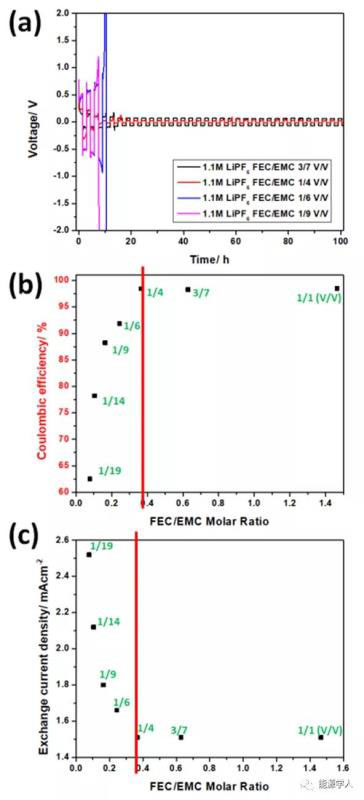
图1. (a)锂对称电池的电压分布,电流密度为2 mA/cm2,电解液为 1.1 M LiPF6-FEC/EMC;(b)锂铜电池库伦效率与FEC/EMC比例的关系,电解液为1.1 M LiPF6-FEC/EMC;(c)锂铜电池中交换电流密度和FEC/EMC比例的影响,电解液为 1.1 M LiPF6-FEC/EMC。
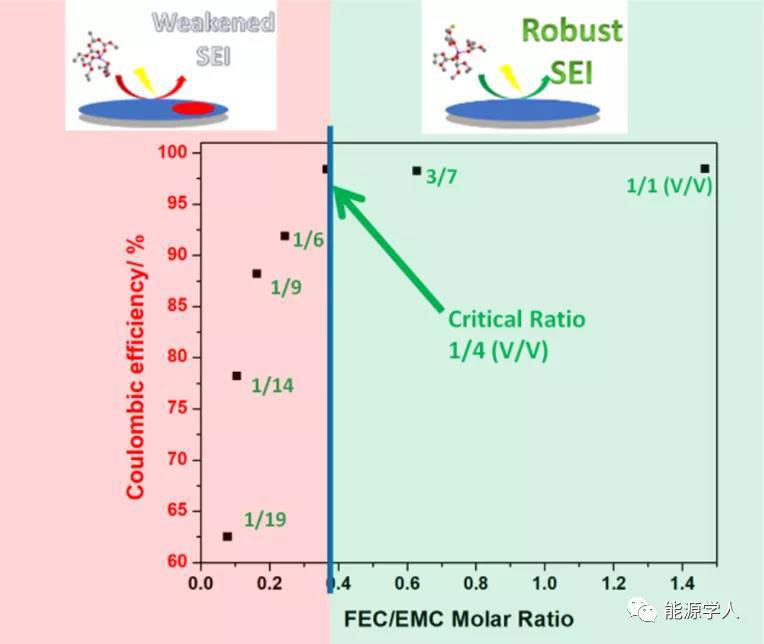
图1a为2 mA/cm2电流密度下循环的Li/Li对称电池的电压分布。采用低FEC体积比电解质的电池(FEC:EMC<1:4)在几个循环后显示出非常高的电压极化(>5V),而使用高FEC含量电解质的电池显示出显著的锂金属稳定性,有助于长期的锂沉积/溶解。为了进一步评价铜工作电极上锂的沉积/溶解效率,作者测定了锂铜电池10圈平均库仑效率(CE)。如图1b所示,平均CE随着FEC与EMC比率的增加而增加,直到体积比达到1:4,对应于0.37摩尔比。FEC含量进一步增加超过1/4体积比对平均CE没有任何影响。
使用Tafel图计算出的交换电流密度i0可来评价Li/Cu电池铜电极表面电荷转移的难度。结果表明,i0值,即零过电位下的平衡电流密度,与电化学过程的动力学有关,随FEC含量的增加而下降,直到体积比达到1:4(图1c)。显然,这个体积比是锂金属与1.1 M LiPF6-FEC/EMC电解液稳定循环的临界点。值得注意的是,作者得到的所有i0值都在同一个数量级上,表明电化学过程的动力学没有大的差别。当FEC含量增加时,i0下降是因为形成了密度更大、氟化锂(LiF)更丰富的SEI,减缓了电荷转移过程。
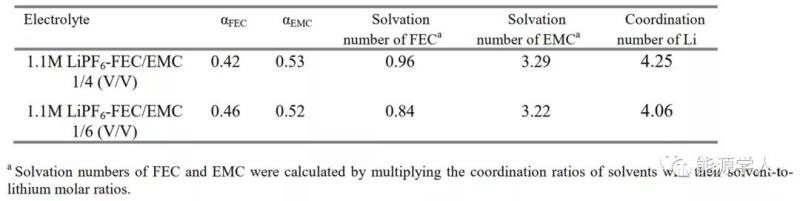
表1. FEC和EMC在1.1M、1/4和1/6 FEC/EMC电解液中的配位比α和溶剂化数。
表1显示了FEC和EMC在两种电解质中的溶剂化数。当FEC/EMC体积比从1/6提高到1/4时,FEC的溶剂化数从0.84增加到0.96(非常接近1)。因此,要实现锂负极的稳定循环,FEC的溶剂化数必须≥1。在这种情况下,几乎所有的锂配合物在形成过程中可优先还原,以构建SEI并在循环过程中修复SEI,而由于不存在单独由EMC溶解Li+的锂络合物,因此没有显著的EMC被分解。
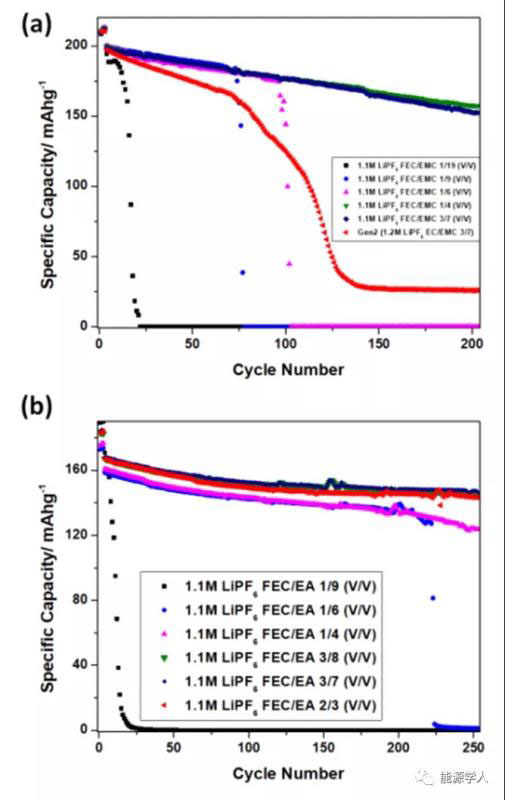
图2. Li/NMC电池循环性能。(a)不同比例1.1 M LiPF6-FEC/EMC;(b)不同比例1.1 M LiPF6-FEC/EA。
Li/LiNi0.8Mn0.1Co0.1O2(NMC811)电池的电化学性能表明了这一溶剂化规律的重要性。图2a为采用不同FEC/EMC比的1.1M LiPF6电解质的Li/NMC811电池的容量保持率和CE。使用1/19 FEC/EMC电解液的电池性能甚至比传统电解液差。它的容量在前20个周期内降至零,这表明在锂阳极上形成的SEI非常不稳定。虽然使用1/9和1/6 FEC/EMC电解质的电池性能有了很大的改善,但容量在100个循环内仍降至零。当FEC/EMC体积比≥1/4时,Li/NMC811电池的循环趋于稳定。当FEC/EMC比例从1/6增加到1/4时,100次循环后的容量保持率从22.3%大幅飙升至88.6%,但进一步将该比率提高至3/7并没有使保留百分比和平均CE有任何增加。总之,1/4体积比代表了使用1.1 M LiPF6-FEC/EMC电解质的锂负极稳定循环的临界值。尽管在长期循环过程中,FEC可能会持续消耗以修复SEI,但FEC基电解液的高临界比意味着FEC的消耗量与电解液的量相比应该是微不足道的。为了进一步验证这一溶剂化规律,用乙酸乙酯(EA)作为共溶剂来代替EMC。由于EA的溶锂能力明显高于EMC,因此1.1 M LiPF6-FEC/EA电解液的临界摩尔比应大于0.37。
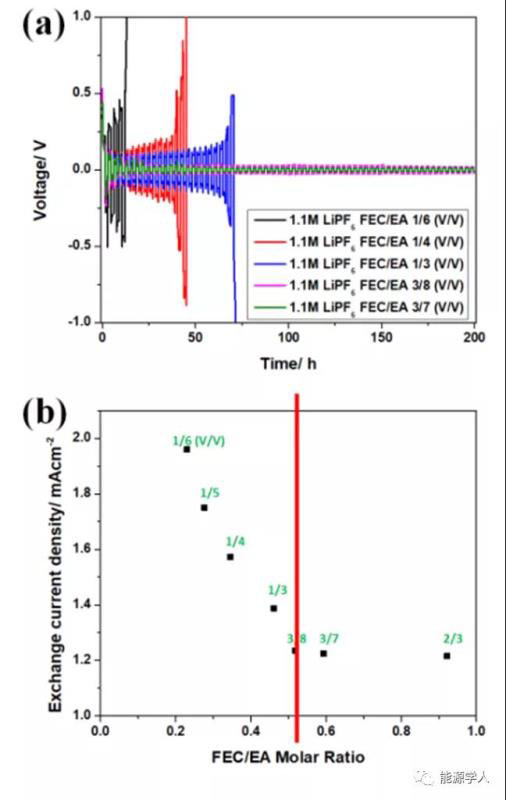
图3.(a) Li/Li对称电池在2 mA/cm2和1.1 M LiPF6-FEC/EA不同比例循环的电压分布;(b)锂铜电池中,交换电流密度与FEC/EA的比值曲线图,1.1 M LiPF6-FEC/EA电解液。
如图3a所示,采用1.1 M LiPF6,1/6、1/4和1/3(v/v)FEC/EA电解质的Li/Li电池在前30圈内显示出非常高的电压极化,当FEC/EA体积比从1/6增加到1/3时,锂的稳定性有所提高。而FEC/EA体积比≥3/8的电池表现出非常稳定的锂离子沉积/溶解。
图3b显示了i0值,这些值是根据相应的Tafel曲线计算的,并根据Li/Cu电池中Li沉积/溶解的FEC/EA摩尔比绘制。与FEC/EMC电解液体系相似,随着FEC/EA摩尔比的增加,i0值逐渐减小,直至达到0.52(体积比为3/8)。之后,进一步提高FEC/EA比值对i0值没有影响。FEC/EA电解液的平均CEs通常高于FEC/EMC电解液,这可能是因为EA分解形成了一个相对更坚固的薄膜。然而,随着FEC/EA体积比的增加,平均CEs逐渐增大,直到达到3/8,这与Li/Li对称电池实验和交换电流密度实验确定的临界体积比相同。使用FEC/EA电解质的Li/NMC811电池的循环结果也与上述结果一致,即3/8是临界体积比(图2b)。
【结论与展望】
综上所述,通过各种电化学和溶剂化研究,揭示了控制锂金属负极稳定循环的溶剂化规律。为了促进锂在电解液中与SEI成膜剂(FEC)/共溶剂(碳酸盐或醋酸盐)的稳定循环,成膜剂FEC的溶剂化数必须≥1,以便在形成过程中优先减少生成SEI,并在随后的循环中修复SEI,确保不分解大量的碳酸盐或醋酸盐。这一溶剂化规则为设计一个稳定的LMBs电解质体系提供了重要的指导。
Chi-Cheung Su, Meinan He, Shi Jiayan, Rachid Amine, Jian Zhang, Khalil Amine, Solvation Rule for Solid-Electrolyte Interphase Enabler in Lithium Metal Batteries. Angew. Chem. Int. Edit. 2020, DOI:10.1002/anie.202008081





